Les biomatériaux de substitution et de reconstruction osseuse
Jean-Louis Lacout "professeur émérite" CIRMAT ENSIACET
Conférence du 27 mars 2013
Que ce soit pour nous-mêmes ou l'un de nos proches, nous sommes tous concernés par l'utilisation de biomatériaux orthopédiques. L'importance de ces biomatériaux ne cesse de croître, pour des raisons diverses liées :
- à notre propre conception du corps : nous ne voulons plus souffrir sans raison, nous souhaitons conserver au maximum notre mobilité, et aussi conserver un corps harmonieux
- à l'augmentation de la longévité qui conduit à des problèmes orthopédiques liés au vieillissement "mécanique" du squelette (défauts des articulations, usure des cartilages), mais aussi à certaines pathologies telles l'ostéoporose
- à l'augmentation des revenus qui permet d'accéder à des techniques parfois coûteuses
- et malheureusement aussi aux nombreux traumatismes dus aux guerres, aux accidents de la circulation, …
Le domaine de la chirurgie orthopédique, de l'art dentaire et des matériaux et prothèses qui y sont associés est donc un domaine en pleine croissance tant sur le plan économique que sur celui de la recherche fondamentale et appliquée. La France, et en particulier Toulouse, ont été et restent en pointe. L'école toulousaine a formé de nombreux chercheurs français et étrangers, essaimé dans de nombreux pays et participé à la création de plusieurs entreprises de fabrication de biomatériaux.
L'utilisation des biomatériaux pour réparer le squelette est très ancienne. Le premier biomatériau rencontré est un morceau de bois calciné, taillé en forme de molaire et retrouvé implanté dans une mâchoire préhistorique. Les dents implantées, en os, en ivoire, en métal se rencontrent en Egypte, chez les Mayas, dans les civilisations romaines. Un premier saut important, dû à Henkel, fut celui de sa prothèse de hanche (en 1950), première vraie prothèse implantée à la fois compatible, fonctionnelle et durable. Le développement s'accélère ensuite touchant à la nature des matériaux, leur design et aussi aux approches et techniques chirurgicales. Un second saut important a été celui de l'utilisation des matériaux phosphatés qui assurent une excellente biocompatibilité. Actuellement les recherches portent sur la relation entre matériaux minéraux et matériaux organiques y compris matériaux vivants. Aborder l'intérêt et le rôle des matériaux de substitution de l'os se fait selon deux approches : définir avec précision ce que l'on exige d'un biomatériau. pour pouvoir l'élaborer ; et pour cela comprendre l'évolution du squelette, comprendre aussi la formation et la vie de l'os.
On demande tout d'abord à un biomatériau d'être biocompatible. On lui demandera en outre, s'il le peut, d'être bioactif, c'est-à-dire, en particulier dans le cas d'un biomatériau orthopédique, de se lier à l'os et même si possible de faciliter la reconstruction osseuse. Bien entendu il doit être fonctionnel, c'est-à-dire posséder les qualités mécaniques nécessaires, et aussi rester efficace dans la durée. Enfin il faut qu'il soit d'un coût abordable, c'est à dire être fabriqué dans un matériau le moins coûteux possible, facilement usinable et dont la mise en place chirurgicale soit la plus simple possible. On conçoit aisément qu'un tel cahier des charges ne peut être abordé et réalisé que par des équipes pluridisciplinaires regroupant des mécaniciens, des métallurgistes, des biologistes, des chirurgiens, des designers, des chimistes.
Le second point concerne la connaissance du squelette et celle de l'os. L'os est essentiellement constitué d'une phase minérale, d'une phase organique et d'eau. Chacune de ces phases est indispensable et participe aux propriétés mécaniques, à la formation de l'os, à son renouvellement. Dès le départ, c'est sur la partie minérale, qui contribue fortement à la solidité de l'os, à ses propriétés mécaniques, tant en flexion qu'en compression, que ce sont portées les premières recherches : remplacer une partie défaillante au moyen d'une prothèse, réaliser un comblement lors d'un défaut osseux pathologique ou traumatique.
La partie minérale est constituée par un phosphate de calcium appelé "apatite". Cette phase minérale est en fait une phase relativement complexe tant par le nombre d'atomes qui forment cette molécule minérale que par les substitutions qu'elle permet (remplacement partiel de certains ions par d'autres).
On peut par exemple noter de nettes différences entre trois formules chimiques données ci-dessous qui correspondent à la formule chimique "idéale", à celle de l'émail dentaire (moyenne) et à celle de l'os mature (moyenne).
Ap a t i t e : Ca10 (PO4)6 (OH)2
Em a i l : Ca9,4 ☐0,6 (PO4)5,4(HPO4 et CO3)0,6 (OH et ½ CO3)1,4 ☐0,,6
Os : Ca8,3 ☐1,7 (PO4)4,3(HPO4 et CO3)1,7 (OH et/ou ½ CO3)0,3 ☐1
Mais cette complexité s'accroît encore si l'on tient compte des états de cristallisation variable de ce matériau, de ses capacités de fixation et d'adsorption d'ions ou de molécules organiques. Cette complexité en fait sa richesse et son admirable adaptabilité qui ont permis aux organismes vertébrés de se développer en gagnant en mobilité, en capacité de défense, en possibilités de reproduction. On peut comprendre que les efforts des chimistes des matériaux tendent à créer le matériau qui sera le plus proche de cette partie minérale.
Comment cette partie minérale, ce biomatériau phosphaté, placé en contact avec le milieu vivant réagit-il ? Il se mettra très rapidement en équilibre avec ce milieu, puis favorisera la précipitation in vivo à sa surface d'une couche minérale et permettra la fixation et la différentiation de cellules capables de fabriquer de l'os. Ainsi, progressivement, le biomatériau initial sera remplacé par un os nouveau. La qualité de l'os nouveau dépendra bien sûr de plusieurs facteurs : les caractéristiques du biomatériau (composition, structure, morphologie,) du site d'implantation, de la vitesse de formation, et des données propres au patient.
Si le choix de biomatériau de structure apatitique, voisine de celle de l'os, est a priori un bon choix, il reste à en déterminer la composition exacte, mais aussi la forme galénique la plus appropriée, essentiellement liée à la localisation de l'implant et à ce qu'on lui demandera.
Ainsi devront être prises en compte les propriétés mécaniques de l'implant, sa morphologie, ses capacités à être substitué ou intégré, sa facilité de mise en œuvre par le chirurgien, les contraintes d'élaboration industrielle en terme de pureté, d'usinage, de stérilisation et aussi le coût.
Il serait très long et très complexe de discuter de façon précise les différentes interaction et compromis entre ces multiples contraintes chimiques, chirurgicales, industrielles et sociales. On peut cependant avoir une petite approche de ces biomatériaux au moyen de trois exemples très différents, présentant des matériaux utilisés en chirurgie orthopédique et dentaire et qui permettront de montrer la diversité des approches, l'interaction forte avec les études et les savoirs fondamentaux et les techniques d'élaboration.
 Le premier exemple concerne l'utilisation de pièces, sous forme de blocs, de petits cubes, de cylindres ou de poudre, en phosphate de calcium destinées à combler des pertes osseuses. De tels matériaux sont maintenant utilisés depuis près de 25 ans. Ils sont relativement faciles à préparer, aisément manipulables, d'un coût abordable. Ces pièces mises en place dans le site d'implantation Projection plasma comblent la lésion permettent à l'os d'implantation comblent la lésion, permettent à l'os de se former en surface ; cet implant, peu biodégradable, reste en place très longtemps ce qui dans la plupart des cas ne pose aucun problème. Cependant, les propriétés mécaniques, liées à celles de la céramique en phosphate de calcium demeurent faibles.
Le premier exemple concerne l'utilisation de pièces, sous forme de blocs, de petits cubes, de cylindres ou de poudre, en phosphate de calcium destinées à combler des pertes osseuses. De tels matériaux sont maintenant utilisés depuis près de 25 ans. Ils sont relativement faciles à préparer, aisément manipulables, d'un coût abordable. Ces pièces mises en place dans le site d'implantation Projection plasma comblent la lésion permettent à l'os d'implantation comblent la lésion, permettent à l'os de se former en surface ; cet implant, peu biodégradable, reste en place très longtemps ce qui dans la plupart des cas ne pose aucun problème. Cependant, les propriétés mécaniques, liées à celles de la céramique en phosphate de calcium demeurent faibles.
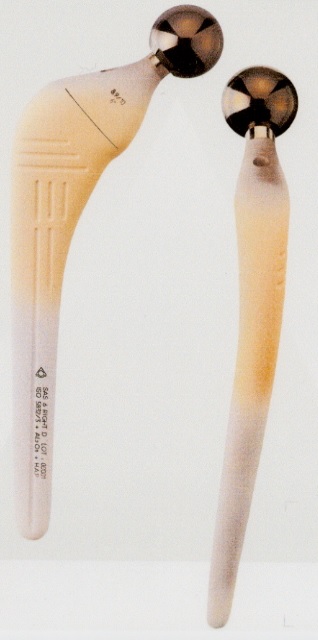 Le second exemple concerne le recouvrement de prothèses, prothèses de hanche, d'épaule, de genoux, implants dentaires. Ce type de prothèse est soumis à de fortes contraintes mécaniques en flexion, cisaillement ou compression. C'est la raison pour laquelle ces prothèses sont réalisées en métal, (aciers spéciaux, alliages de titane) et donnent d'excellents résultats.
Le second exemple concerne le recouvrement de prothèses, prothèses de hanche, d'épaule, de genoux, implants dentaires. Ce type de prothèse est soumis à de fortes contraintes mécaniques en flexion, cisaillement ou compression. C'est la raison pour laquelle ces prothèses sont réalisées en métal, (aciers spéciaux, alliages de titane) et donnent d'excellents résultats.
Cependant, il est assez évident que la liaison entre le métal et les tissus environnants n'est pas naturelle et on est dans la plupart des cas tenu à fixer cette prothèse au moyen un ciment organique qui polymérise in situ.
 Une solution heureuse, qui évite l'emploi de ce ciment-colle, qui pose certains problèmes, consiste à recouvrir la pièce prothétique par un phosphate de calcium qui réalisera l'interface biologique active avec l'os environnant. La technique utilisée est une technique "par projection plasma" développée initialement dans le traitement de pièces mécaniques pour l'aéronautique et l'automobile. Elle consiste à projeter à très haute vitesse et à très haute température des particules de phosphate de calcium sur la surface de la prothèse. Un dépôt très fin (quelques centaines de microns), très adhérent, est ainsi formé. Ce dépôt qui sera actif, se liera à l'os et permettra le maintien de la prothèse métallique qui assurera elle les propriétés fonctionnelles. Cette technique est largement développée mais est toujours en évolution : modification de la nature exacte du dépôt projeté, choix des meilleures conditions de dépôts et aussi recherche de nouvelles voies de recouvrement.
Une solution heureuse, qui évite l'emploi de ce ciment-colle, qui pose certains problèmes, consiste à recouvrir la pièce prothétique par un phosphate de calcium qui réalisera l'interface biologique active avec l'os environnant. La technique utilisée est une technique "par projection plasma" développée initialement dans le traitement de pièces mécaniques pour l'aéronautique et l'automobile. Elle consiste à projeter à très haute vitesse et à très haute température des particules de phosphate de calcium sur la surface de la prothèse. Un dépôt très fin (quelques centaines de microns), très adhérent, est ainsi formé. Ce dépôt qui sera actif, se liera à l'os et permettra le maintien de la prothèse métallique qui assurera elle les propriétés fonctionnelles. Cette technique est largement développée mais est toujours en évolution : modification de la nature exacte du dépôt projeté, choix des meilleures conditions de dépôts et aussi recherche de nouvelles voies de recouvrement.
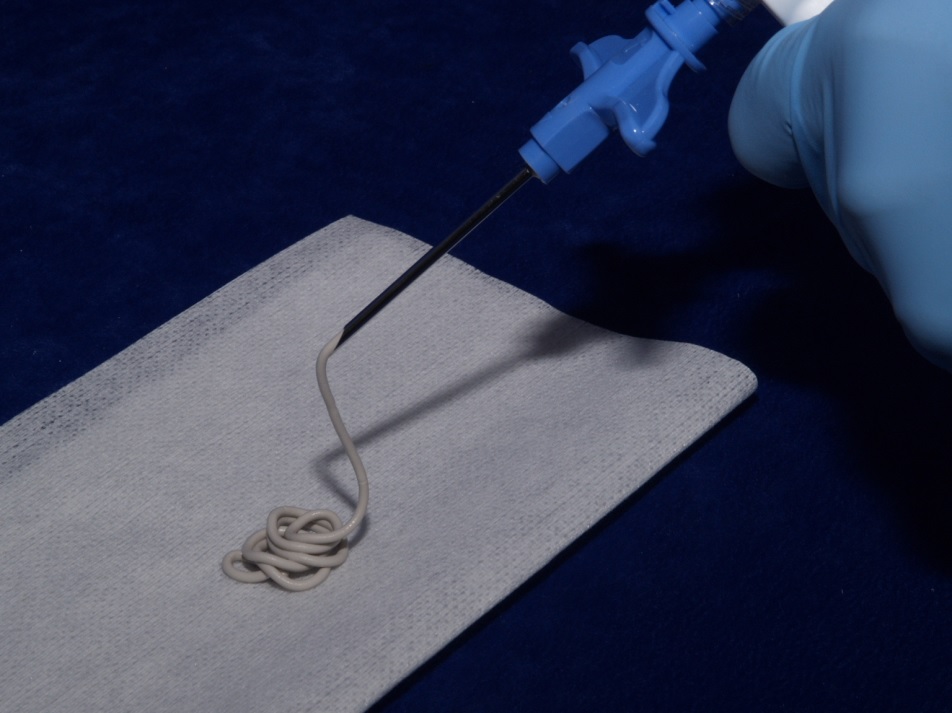 Un troisième exemple concerne l'utilisation de ciments minéraux phosphatés. Un ciment, qu'il soit de construction ou orthopédique est un produit préparé par mélange d'une phase solide et d'une phase liquide, qui forme une pâte malléable, puis qui fait prise sur le site sur lequel il est placé. Le ciment orthopédique minéral offre la possibilité au chirurgien de s'adapter à la forme de la partie à combler, de pouvoir être injecté et mis en place à courte ou moyenne distance, de permettre une intervention sous radioscopie sans intervention en chirurgie ouverte. Le phosphate de calcium apatitique dont la morphologie cristalline est de type aciculaire, c'est-à-dire sous forme d'aiguilles, dont les capacités de liaison inter cristallines sont grandes peut lorsqu'il cristallise former une structure cohérente due à l'enchevêtrement des cristaux et aux forces inter cristaux. On se trouve ainsi dans la configuration d'un ciment. Plusieurs types de ciments apatitiques existent, avec des précurseurs ou des protocoles différents, mais qui concourent tous au même résultat : la formation transitoire d'une phase pâteuse qui mise en place dans le site d'intervention pourra faire prise et durcir. La figure montre le ciment qui après gâchage est introduit dans une seringue ce qui permet l'injection dans le site au moyen d'un trocart. La facilité d'utilisation pour le chirurgien est aisément compréhensible.
Un troisième exemple concerne l'utilisation de ciments minéraux phosphatés. Un ciment, qu'il soit de construction ou orthopédique est un produit préparé par mélange d'une phase solide et d'une phase liquide, qui forme une pâte malléable, puis qui fait prise sur le site sur lequel il est placé. Le ciment orthopédique minéral offre la possibilité au chirurgien de s'adapter à la forme de la partie à combler, de pouvoir être injecté et mis en place à courte ou moyenne distance, de permettre une intervention sous radioscopie sans intervention en chirurgie ouverte. Le phosphate de calcium apatitique dont la morphologie cristalline est de type aciculaire, c'est-à-dire sous forme d'aiguilles, dont les capacités de liaison inter cristallines sont grandes peut lorsqu'il cristallise former une structure cohérente due à l'enchevêtrement des cristaux et aux forces inter cristaux. On se trouve ainsi dans la configuration d'un ciment. Plusieurs types de ciments apatitiques existent, avec des précurseurs ou des protocoles différents, mais qui concourent tous au même résultat : la formation transitoire d'une phase pâteuse qui mise en place dans le site d'intervention pourra faire prise et durcir. La figure montre le ciment qui après gâchage est introduit dans une seringue ce qui permet l'injection dans le site au moyen d'un trocart. La facilité d'utilisation pour le chirurgien est aisément compréhensible.
Ces ciments, préparés à la température ordinaire sont assez mal cristallisés. Leurs qualités d'intégration sont certaines ; il reste cependant souvent à ajuster leurs propriétés de résorption, liées à leur état de cristallinité, leur porosité et leur composition précise. Un des intérêts des ciments est de pouvoir leur ajouter des molécules actives lors de leur préparation : des molécules antalgiques, antimitotiques, antibiotiques. pour autant que ces molécules ne perturbent ni l'injection ni la prise du ciment. Elles peuvent ensuite être libérées progressivement sur le site d'intervention.
On voit que par cette démarche on s'approche de biomatériaux à caractère "très actif". C'est ainsi que l'on peut voir le développement des biomatériaux phosphatés, dans une association de plus en plus étroite avec des molécules actives, de type médicaments, mais aussi avec des cellules telles des cellules souches et bien d'autres composés du vivant (par exemple des facteurs de croissance) susceptibles d'aider à la reconstruction osseuse.
On dépasse alors le cadre strict des biomatériaux pour aller vers celui d'une nouvelle classe de biomatériaux/médicaments.